Halo sahabat latis education!
Sumber: Freepik
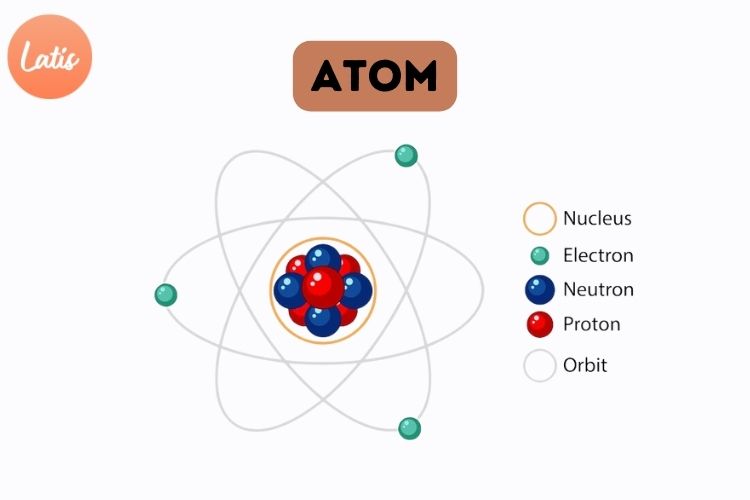
Atom adalah unit dasar dari segala materi di alam semesta. Setiap atom terdiri dari tiga partikel subatomik utama, yaitu proton, neutron, dan elektron. Atom-atom berbeda berdasarkan jumlah proton di dalam intinya, yang dikenal sebagai nomor atom, dan hal ini menentukan identitas unsur.
Atom dapat bergabung satu sama lain melalui ikatan kimia untuk membentuk molekul, yang merupakan dasar dari berbagai zat dan senyawa kimia. Dengan mempelajari atom, kita dapat memahami sifat-sifat dasar materi serta reaksi kimia yang terjadi di alam.
Baca juga: bimbel intensif utbk
Komponen-Komponen Atom
Sumber: Freepik
Simak komponen-komponen atom, peran masing-masing komponen, serta bagaimana struktur ini membentuk dunia fisik yang kita kenal:
1. Inti Atom
Inti atom, atau nukleus, terletak di pusat atom dan menjadi bagian paling padat dari struktur atom. Inti ini mengandung proton dan neutron, yang bersama-sama disebut nukleon. Meskipun hanya berukuran sangat kecil, inti atom menyimpan hampir seluruh massa atom karena proton dan neutron memiliki massa yang jauh lebih besar dibandingkan dengan elektron.
2. Proton
Proton adalah partikel subatomik yang memiliki muatan positif dan berada di dalam inti atom. Proton memiliki massa sekitar 1,67 x 10^-27 kilogram, yang mendekati massa neutron. Jumlah proton dalam inti atom menentukan identitas kimia dari suatu unsur. Misalnya, atom hidrogen memiliki satu proton, sementara atom karbon memiliki enam proton. Jumlah proton dalam suatu atom juga disebut sebagai nomor atom, yang menjadi penentu utama jenis unsur tersebut.
3. Neutron
Neutron adalah partikel yang tidak memiliki muatan atau bersifat netral dan juga berada di dalam inti atom. Sama seperti proton, neutron memiliki massa yang signifikan, hampir sama dengan massa proton. Neutron membantu menyeimbangkan muatan dalam inti dan mencegah proton yang bermuatan positif untuk saling tolak. Jumlah neutron dalam atom dapat bervariasi bahkan dalam satu unsur yang sama, menghasilkan isotop, yaitu variasi atom dengan jumlah neutron yang berbeda.
4. Elektron
Elektron adalah partikel subatomik bermuatan negatif yang bergerak mengelilingi inti atom dalam orbit tertentu. Elektron memiliki massa yang sangat kecil, sekitar 9,11 x 10^-31 kilogram, atau kurang dari 1/1800 massa proton atau neutron. Elektron bergerak dalam orbit atau tingkat energi yang berbeda, dan pergerakannya dikendalikan oleh gaya elektrostatik yang menariknya ke arah inti yang bermuatan positif.
5. Model Atom Bohr
Niels Bohr, seorang fisikawan Denmark, mengembangkan model atom yang menyatakan bahwa elektron mengelilingi inti dalam orbit dengan tingkat energi tertentu. Dalam model ini, elektron akan berada pada tingkat energi tertentu dan tidak dapat berada di antara tingkat energi tersebut. Ketika elektron berpindah dari satu tingkat energi ke tingkat lainnya, energi akan diserap atau dilepaskan dalam bentuk cahaya. Model Bohr menjadi dasar pemahaman struktur atom meskipun telah dimodifikasi dengan konsep mekanika kuantum.
6. Massa Atom
Massa atom adalah jumlah massa proton dan neutron dalam atom, karena elektron memiliki massa yang sangat kecil sehingga dianggap tidak signifikan dalam perhitungan massa atom. Massa atom biasanya diukur dalam satuan massa atom (amu), di mana satu proton atau neutron kira-kira setara dengan 1 amu.
7. Isotop
Unsur yang sama dapat memiliki jumlah neutron yang berbeda, menghasilkan isotop. Misalnya, karbon memiliki isotop karbon-12 dan karbon-14. Meskipun jumlah protonnya sama, perbedaan jumlah neutron membuat isotop memiliki sifat tertentu, seperti kecenderungan meluruh yang dapat dimanfaatkan dalam penanggalan radioaktif.
8. Ion
Atom dapat kehilangan atau mendapatkan elektron, dan ini menghasilkan ion. Jika atom kehilangan elektron, ia menjadi kation yang bermuatan positif. Sebaliknya, jika mendapatkan elektron, ia menjadi anion yang bermuatan negatif. Ion berperan penting dalam berbagai reaksi kimia dan dalam pembentukan ikatan antaratom.
Baca juga: bimbel utbk murah
Jenis-Jenis Atom Berdasarkan Kelompok dalam Tabel Periodik
Sumber: Freepik
Berikut ini adalah penjelasan tentang jenis-jenis atom berdasarkan kelompoknya dalam tabel periodik.
1. Kelompok 1 - Logam Alkali
Kelompok 1, atau logam alkali, terdiri dari unsur-unsur seperti litium (Li), natrium (Na), kalium (K), rubidium (Rb), sesium (Cs), dan fransium (Fr). Unsur-unsur ini dikenal sangat reaktif, terutama saat bereaksi dengan air, dan sifat reaktivitasnya meningkat dari atas ke bawah tabel periodik. Logam alkali biasanya memiliki titik leleh rendah dan hanya membutuhkan satu elektron untuk mencapai konfigurasi stabil. Ini membuat mereka sangat reaktif dan lebih sering ditemukan dalam bentuk senyawa daripada dalam keadaan bebas.
2. Kelompok 2 - Logam Alkali Tanah
Kelompok 2 terdiri dari logam alkali tanah seperti berilium (Be), magnesium (Mg), kalsium (Ca), stronsium (Sr), barium (Ba), dan radium (Ra). Unsur-unsur dalam kelompok ini juga reaktif, tetapi tidak seaktif logam alkali. Mereka cenderung ditemukan dalam bentuk senyawa, khususnya mineral di kerak bumi. Logam alkali tanah memiliki dua elektron di kulit terluar mereka, sehingga mereka cenderung melepaskan dua elektron untuk membentuk ion dengan muatan +2.
3. Kelompok 13 - Golongan Boron
Kelompok 13, atau golongan boron, meliputi unsur-unsur seperti boron (B), aluminium (Al), galium (Ga), indium (In), dan talium (Tl). Unsur-unsur dalam kelompok ini memiliki tiga elektron di kulit terluar dan biasanya membentuk senyawa dengan muatan +3. Boron adalah metaloid, sementara anggota kelompok lainnya merupakan logam. Aluminium, yang merupakan salah satu logam paling banyak di bumi, banyak digunakan dalam industri karena ringan dan tahan korosi.
4. Kelompok 14 - Golongan Karbon
Kelompok 14 terdiri dari unsur karbon (C), silikon (Si), germanium (Ge), timah (Sn), dan timbal (Pb). Kelompok ini dikenal sebagai golongan karbon. Karbon adalah unsur penting dalam kimia organik, sedangkan silikon adalah bahan utama dalam industri elektronik. Kelompok ini memiliki empat elektron di kulit terluar, yang memungkinkan unsur-unsurnya membentuk ikatan kovalen yang kuat. Sifat-sifat unsur dalam kelompok ini bervariasi dari non-logam (karbon) hingga logam (timbal).
5. Kelompok 18 - Gas Mulia
Gas mulia, atau kelompok 18, mencakup unsur-unsur seperti helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), dan radon (Rn). Gas mulia memiliki konfigurasi elektron yang stabil, sehingga sangat sedikit berinteraksi dengan unsur lain. Mereka tidak reaktif dan sering ditemukan dalam keadaan bebas. Gas mulia banyak digunakan dalam industri, seperti argon dalam pengelasan dan helium dalam balon udara.
Baca juga: harga les privat
Manfaat atom dalam kehidupan sehari-hari
Sumber: Freepik
Berikut adalah beberapa manfaat utama atom dalam kehidupan sehari-hari dan perkembangan ilmu pengetahuan.
1. Sumber Energi Nuklir
Atom memainkan peran penting dalam pembangkitan energi nuklir. Reaksi pembelahan (fisi) atom-atom tertentu, seperti uranium-235 dan plutonium-239, menghasilkan energi yang sangat besar. Proses ini digunakan dalam reaktor nuklir untuk menghasilkan listrik. Kelebihan energi nuklir adalah efisiensinya yang tinggi, karena hanya sedikit bahan bakar yang diperlukan untuk menghasilkan energi dalam jumlah besar. Pembangkit listrik tenaga nuklir adalah sumber energi yang lebih bersih dibandingkan dengan pembakaran bahan fosil, karena tidak menghasilkan gas rumah kaca dalam jumlah besar.
2. Penerapan dalam Kedokteran Nuklir
Dalam bidang kedokteran, atom radioaktif digunakan dalam diagnosis dan pengobatan. Misalnya, teknik pencitraan seperti PET (Positron Emission Tomography) memanfaatkan isotop radioaktif untuk mendeteksi penyakit dalam tubuh, termasuk kanker. Selain itu, terapi radiasi yang memanfaatkan sinar gamma atau partikel beta dari unsur radioaktif dapat membantu membunuh sel-sel kanker tanpa operasi. Teknologi ini memungkinkan diagnosis dini serta pengobatan yang lebih presisi.
3. Penerapan dalam Industri Pertanian
Atom juga digunakan dalam industri pertanian untuk meningkatkan hasil panen dan menjaga ketahanan pangan. Radiasi gamma yang dihasilkan dari isotop radioaktif dapat digunakan untuk memperpanjang umur simpan produk pangan dengan cara membunuh bakteri dan hama pada hasil pertanian. Proses ini dikenal sebagai iradiasi pangan. Selain itu, atom dapat digunakan dalam penelitian pemupukan tanaman untuk memastikan bahwa nutrisi dalam tanah sesuai dengan kebutuhan tanaman.
4. Pemanfaatan dalam Penelitian Ilmu Pengetahuan dan Teknologi
Atom adalah dasar dari berbagai penelitian ilmiah, terutama dalam bidang kimia, fisika, dan biologi. Pemahaman struktur atom memungkinkan para ilmuwan untuk mempelajari sifat-sifat material, menciptakan bahan-bahan baru, dan mengembangkan teknologi yang lebih canggih. Misalnya, di bidang nanoteknologi, para ilmuwan memanipulasi atom untuk menciptakan material dengan sifat khusus yang sangat bermanfaat di berbagai industri, seperti elektronik, kedokteran, dan lingkungan.
Baca juga: Les Privat Calistung
Segera cek sosial media kami di Instagram Bimbel UTBK SNBT SIMAK UI - Latis Education, line telepon (021) 77844897 atau kamu juga bisa menghubungi kami melalui 085810779967 . Atau klik www.latiseducation.com untuk mendapatkan informasi lebih lanjut.
Sampai bertemu di Latis Education!
Referensi:
- idntimes.com
- bhinneka.com