Halo sahabat Latis, tahukah kamu tentang cara mengubah air menjadi gas? Atau cara mencegah karat pada besi? Salah satu caranya adalah dengan pelapisan logam menggunakan logam lain yang tidak mudah berkarat. Pada teknik ini logam dilapisi logam lain menggunakan proses elektrolisis.
Yuk, hari ini kita pelajari materi kimia tentang redoks dan elektrokimia! Materi kali ini akan membahas sel elektrolisis dan hukum Faraday.
Prinsip Kerja Sel Elektrolisis
Sel elektrolisis merupakan sel elektrokimia yang mana energi listrik digunakan untuk menjalankan reaksi redoks itu tidak spontan. Elektrolisis dapat didefinisikan sebagai reaksi peruraian zat menggunakan arus listrik.
Prinsip kerja dari sebuah sel elektrolisis adalah menghubungkan kutub negatif dari sumber arus searah dengan katoda dan kutub positif ke anoda, sehingga terjadi overpotential yang menyebabkan suatu reaksi reduksi serta oksidasi yang tidak spontan bisa berlangsung.
Elektron akan mengalir dari katode ke anode. Ion-ion positif akan cenderung tertarik ke katode dan juga tereduksi, sedangkan untuk ion-ion negatif akan cenderung tertarik ke anode dan teroksidasi.
Susunan Sel Elektrolisis
Secara umum, sel elektrolisis ini tersusun dari:
- Sumber listrik arus searah (DC), berupa baterai atau aki
- Elektroda, anoda dan katoda. Berupa inert atau non inert
- Elektrolit, zat penghantar listrik berupa asam atau garam
Ketentuan Reaksi dalam Sel Elektrolisis
a. Reaksi Reduksi di Katoda
Tidak bergantung dari jenis elektrodanya.
1) H+ dari asam akan direduksi menjadi H2
Reduksi kation H+
Reaksi 2H+ (aq) + 2e → H2 (g)
2) Kation dari larutan yang mengandung ion golongan IA, IIA, IIIA dan Mn2+ dalam bentuk larutan tidak mengalami reduksi. H2O yang akan direduksi menurut reaksi :
2H2O (l) + 2e → H2 (g) + 2 OH- (aq)
3) Kation Lx+ dari lelehan garam IA, IIA, IIIA.
Terjadi reduksi kation garam tersebut.
Reaksi Lx+ (aq) + xe → L (s)
4) Kation dari garam selain dari golongan IA, IIA, IIIA dan Mn2+
Terjadi reduksi kation tersebut.
Reaksi : Lx+ + xe → L
b. Reaksi Oksidasi di Anoda
Reaksi yang terjadi tergantung dari jenis elektroda.
1) Anoda dari logam aktif (M)
Terjadi oksidasi elektroda tersebut.
M (s) → Mx+ (aq) + xe
2) Anoda dari bahan inert (C, Au atau Pt)
Terjadi oksidasi anion atau molekul air dengan ketentuan, yang berada dalam larutan.
- Jika anion dari larutan garam halida(X-), Terjadi oksidasi anion tersebut, dengan reaksi : 2X- (aq) → X2 (g)+ 2e
- Jika anion beroksigen (SO4 2- , NO3 - , CO3 2- , PO4 3-), maka reaksi oksidasi air, menurut reaksi : 2H2O(l) → O2 (g) + 4H+ (aq) + 4e
- Jika anion dari basa (OH-) maka oksidasi ion OH- tersebut. Reaksi : 4OH- (aq) → O2(g) + 2H2O(l) + 4e
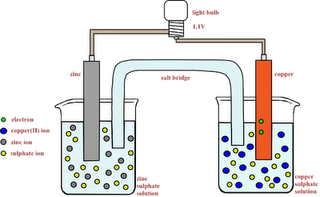
Hukum Faraday
Hukum-hukum elektrolisis Faraday menyatakan hubungan antara massa zat yang dihasilkan di elektroda dengan muatan listrik yang disuplai pada elektrolisis. Aspek kuantitatif dari sel elektrolisis meliputi massa zat hasil, volume gas hasil, jumlah mol elekron, kuat arus, waktu elektrolisis. Dalam hal ini hukum Faraday dinyatakan dalam 2 hukum, yaitu hukum Faraday I dan hukum Faraday II.
Hukum Faraday dapat digunakan untuk menyatakan aspek kuantitatif zat-zat yang terlibat dalam reaksi dalam sel elektrolisis. Aspek kuantitatif tersebut dapat berupa massa (W), volume (V), jumlah mol elektron, kuat arus (i) dan waktu (t) elektrolisis.
Hukum Faraday I
Menyatakan bahwa massa zat yang diendapkan atau dilarutkan sebanding dengan muatan yang dilewatkan dalam sel dan massa ekivalen zat tersebut Hukum Faraday I dinyatakan dalam rumusan :
𝑊 = 𝑒 × 𝑖 × 𝑡 𝐹
Dimana 𝑒 = 𝐴𝑟 𝑛
Sehingga hukum Faraday dapat ditulis sebagai berikut:
𝑊 = 𝐴𝑟 𝑛 𝑥 𝑖 × 𝑡 𝐹
Hukum Faraday II
Menyatakan bahwa “Massa zat yang dihasilkan pada suatu elektroda selama elektrolisis (W) berbanding lurus dengan massa ekivalen (e) zat tersebut.”
Jadi jika sel elektrolisis disusun secara seri, didapatkan suatu persamaan:
𝑊1 / 𝑊2 = 𝑒1 / 𝑒2
Contoh Soal
- Jumlah Faraday arus yang diperlukan untuk reaksi oksidasi 1 mol H2S dengan KMnO4 menghasilkan H2SO4 dan MnO2 adalah …
Jawab:
Reaksi S2- + 4H2O → SO4 2- + 8H+ + 8e
Mol S2- : mol elektron = 1 :8
Jumlah Faraday = jumlah mol elektron = 8 mol
Baca juga: Blog Supercamp Almuni UI
Gimana sobat, udah mulai paham kan dengan materi ini? Supaya kamu makin paham dengan materi lainnya, bisa jawab PR dan tugas di sekolah dengan mudah dan prestasimu meningkat tajam, kamu bisa coba ikutan les privat Latiseducation lho.. gurunya bagus-bagus dan biayanya hemat. Bisa online dan tatap muka juga
Nah, itulah pembahasan materi kali ini. Apabila ada pertanyaan atau pendapat yang ingin disampaikan, Anda bisa langsung serukan di kolom komentar di bawah yaaaah…
Anda juga dapat menghubungi kami di 085810779967 atau Head Office kami 021-77844897 di setiap hari Senin s.d Jumat pada pukul 09.00-17.00.
Anda bisa menemui kami langsung di kantor Ocean Terrace Residence Blok E1 No.1 Jalan Tole Iskandar, Tirtajaya, Kec. Sukmajaya, Kota Depok, Jawa Barat. Latis Education melayani les privat untuk semua wilayah di Indonesia.
Sumber: Repositori Kemdikbud
















