Halo sahabat Latis, tahukah kamu bahwa ada banyak senyawa-senyawa yang ada di bumi ini? Yuk, hari ini kita pelajari materi kimia tentang senyawa karbon agar kamu bisa lebih paham!
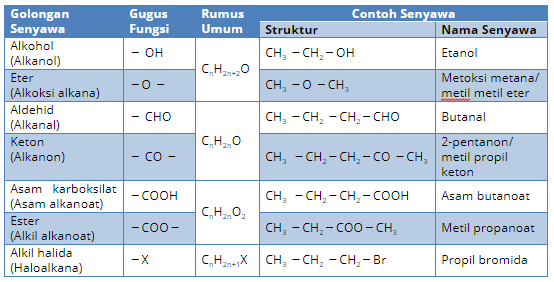
Alkohol
Struktur Alkohol diperoleh dengan menggantikan satu atom H dengan gugus -OH. Penamaan alkohol juga disesuaikan dengan nama alkana dengan mengubah huruf akhir a pada alkana dengan ol. Misalkan metana menjadi metanol.
Sifat Fisik alkohol
1) Titik didih Titik didih alkohol relatif tinggi karena adanya daya tarik antarmolekul yang kuat. Titik didih adalah ukuran kasar dari jumlah energi yang diperlukan oleh molekul cair untuk memisahkan diri dari molekul terdekatnya. Jika molekul terdekatnya terikat dengan ikatan hidrogen, maka dibutuhkan energi yang cukup besar untuk memutus ikatan hidrogen agar molekul terlepas dari cairan menjadi gas
2) Kelarutan Alkohol Kepolaran dan ikatan hidrogen merupakan faktor yang menentukan besarnya kelarutan alkohol dan eter dalam air. Dalam membahas kelarutan, kita menggunakan prinsip like dissolves like yang berarti pelarut polar melarutkan zat terlarut polar dan pelarut nonpolar melarutkan zat terlarut nonpolar. Akan tetapi prinsip tersebut tidak berlaku untuk semua kasus. Semua alkohol adalah polar tetapi tidak semua alkohol dapat larut dalam air
Sifat Kimia
Alkohol Alkohol mengalami reaksi dehidrasi, oksidasi, reaksi dengan logam Na dan K, esterifikasi, dan reaksi hidrogen halida.
1) Dehidrasi alkohol Dehidrasi merupakan reaksi terlepasnya H dan OH. Reaksi dehidrasi alkohol dapat membentuk alkena atau eter dan air. Asam sulfat pekat berlebih dicampurkan dalam alkohol kemudian campuran tersebut dipanaskan hingga 180 °C, maka gugus hidroksil akan terlepas dan atom hidrogen dari karbon terdekatnya juga terlepas, membentuk H2O.
2) Oksidasi alkohol Oksidasi alkohol menghasilkan senyawa yang berbeda, tergantung jenis alkohol.
3) Reaksi alkohol dengan logam Na atau K Alkohol kering (tidak mengandung air) dapat bereaksi dengan logam Na dan K tetapi tidak sereaktif air dengan logam Na ataupun K. Atom H dari gugus –OH digantikan dengan logam tersebut sehingga terbentuk Na-alkoholat.
4) Esterifikasi Alkohol dengan asam alkanoat dapat membentuk ester. Reaksi ini disebut dengan reaksi esterifikasi
5) Reaksi dengan hidrogen halida Alkohol direaksikan dengan hidrogen halida menghasilkan haloalkana dan air.
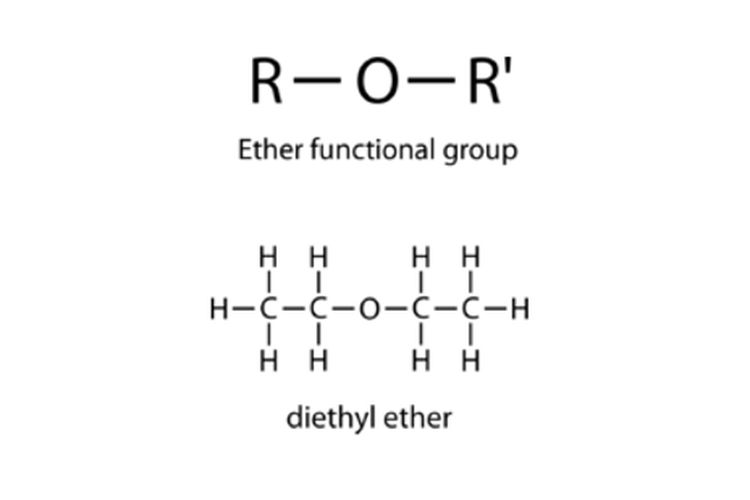
Eter
Eter termasuk senyawa turunan alkana yang memiliki gugus alkoksi (−OR′) dan rumus umum CnH2n+2O. Eter dapat dilihat sebagai dua gugus alkil, yakni R dan R′ yang terikat pada satu atom O. Struktur eter diperoleh dengan menggabungkan dua buah alkil dengan oksigen. Oleh karena itu eter juga disebut dengan alkoksi alkana. Eter yang paling sederhana adalah dimetil eter: CH3 –O–CH3 . Untuk memperjelas struktur eter, gunakan molymod (model atom dan unsur) untuk membentuk struktur eter.
Sifat Fisika Eter
Titik didih Kedua alkil pada eter terikat pada oksigen sehingga tidak dapat membentuk ikatan hidrogen maka titik didih eter lebih kecil dibanding alkohol dengan massa molekul relatif yang sama.
b. Kelarutan Eter tidak dapat membentuk ikatan hidrogen antar molekulnya karena tidak ada hidrogen yang terikat pada oksigen, tetapi jika dicampur dengan air, eter dapat membentuk ikatan hidrogen dengan air. Oleh karena itu eter sedikit larut dalam air.
Sifat Kimia Eter
Eter bersifat inert seperti alkana, eter tidak bereaksi dengan oksidator, reduktor maupun basa. Sifat inilah yang menyebabkan eter banyak digunakan sebagai pelarut organik.
Aldehid
Aldehid merupakan senyawa turunan alkana yang mengandung gugus aldehid atau disebut juga Alkanal dengan rumus molekul CnH2nO. Alkanal atau aldehid merupakan senyawa karbon yang mempunyai gugus karbonil pada ujung rantai C.
Sifat fisis
(a) Alkanal (metanal) berwujud gas pada suhu kamar, suku yang lebih banyak akan berwujud cair
(b) Titik didih dan titik leleh lebih rendah dari senyawa alkanol dengan jumlah C sama
(c) Alkanal merupakan senyawa polar
(d) Kelarutan semakin berkurang dengan bertambahnya jumlah suku atom C
(e) Termasuk senyawa non elektrolit
Sifat kimia
(a) Tidak membentuk ikatan hidrogen antara senyawa alkanal
(b) Kereaktifan alkanal lebih reaktif daripada keton
(c) Reaksi adisi alkanal
Reaksi oksidasi alkanal
(a) Oksidasi dengan oksidator kuat yaitu KMnO4 atau K2 Cr2 O7 membentuk asam alkanoat
(b) Oksidasi dengan pereaksi Tollens (campuran AgNO3 + NH4 OH)
(c) Oksidasi dengan pereaksi Fehling
Keton/Alkanol
Alkanon atau keton merupakan senyawa karbon yang kedua tangannya diikat oleh gugus alkil (R). Gugus alkil yang diikat berjumlah sama atau tidak sama.
Sifat fisis
(a) Termasuk senyawa polar dan larut dalam air
(b) Titik didih alkanon atau keton lebih tinggi dibandingkan dengan senyawa hidrokarbon dengan massa molekul relatif sama
(c) Senyawa alkana mempunyai sifat fisis hampir sama untuk molekul yang bersesuaian
Sifat kimia
(a) Antar senyawa alkanon tidak terjadi ikatan hidrogen
(b) Alkanon kurang reaktif daripada aldehid
(c) Alkanon merupakan reduktor yang sangat lemah
(d) Reaksi adisi
Asam Karboksilat/Alkanoat
Asam alkanoat merupakan senyawa karbon turunan alkana yang mempunyai gugus fungsional.
Sifat fisis
a) Pada suhu kamar, asam alkana suku rendah berwujud cair, suku diatasnya berwujud cair agak kental, dan suku yang lebih tinggi berwujud padat
b) Titik didih dan titik leleh asam alkanoat lebih tinggi daripada alkanol
c) Asam alkanoat dengan suku C1 – C4 mudah larut dalam air, suku C5 – C6 sedikit larut dalam air, dan lebih dari C7 tidak larut dalam air
d) Asam alkanoat merupakan senyawa elektrolit lemah semakin panjang rantai C, maka keasamannya makin lemah.
Sifat Kimia
a) Mempunyai ikatan hidrogen sehingga dapat berikatan hidrogen dengan molekul air dan sesamanya
b) Sifat asam alkanoat pada suku tinggi makin lemah sehingga kereaktifannya juga makin lemah
c) Reaksi asam alkanoat sebagai berikut:
(1) Reaksi dengan basa NaOH membentuk garam dimana atom H dari gugus karboksil diganti dengan logam
(2) Reaksi pembentukan ester dari asam alkanoat dan alkanon (reaksi esterifikasi). Atom H dari COOH diganti dengan gugus alkil dari alkanol
(3) Reaksi dengan halogen (X) khususnya Cl dan Br menghasilkan asam halida alkanoat dengan bantuan sinar matahari, fosfor, dan belerang
4) Reaksi dengan NH3 membentuk golongan amida, mengganti gugus OH dari COOH dengan NH2
Ester (Alkil alkanoat)
Alkil alkanoat merupakan senyawa karbon turunan dari asam alkanoat dimana gugus hidroksil (-OH) asam alkanoat diganti dengan gugus alkoksi (R –– O)
Sifat fisis
a) Titik didih dan titik leleh alkil alkanoat lebih rendah dari asam alkanoat.
b) Alkil alkanoat lebih mudah menguap dibandingkan asam atau alkanol
c) Alkil alkanoat berbau harum dan sedikit larut dalam air
d) Alkil alkanoat merupakan senyawa nonelektrolit
Sifat kimia
a) Tidak memiliki ikatan hidrogen, tetapi memiliki ikatan Van Der Waals.
b) Alkil alkanoat merupakan senyawa yang kurang reaktif
c) Reaksi pada senyawa alkil alkanoat, antara lain: (1) Hidrolisis dengan H2O
Baca juga: Blog Supercamp Almuni UI
Gimana sobat, udah mulai paham kan dengan materi ini? Supaya kamu makin paham dengan materi lainnya, bisa jawab PR dan tugas di sekolah dengan mudah dan prestasimu meningkat tajam, kamu bisa coba ikutan les privat Latiseducation lho.. gurunya bagus-bagus dan biayanya hemat. Bisa online dan tatap muka juga
Nah, itulah pembahasan materi kali ini. Apabila ada pertanyaan atau pendapat yang ingin disampaikan, Anda bisa langsung serukan di kolom komentar di bawah yaaaah…
Anda juga dapat menghubungi kami di 085810779967 atau Head Office kami 021-77844897 di setiap hari Senin s.d Jumat pada pukul 09.00-17.00.
Anda bisa menemui kami langsung di kantor Ocean Terrace Residence Blok E1 No.1 Jalan Tole Iskandar, Tirtajaya, Kec. Sukmajaya, Kota Depok, Jawa Barat. Latis Education melayani les privat untuk semua wilayah di Indonesia.
Sumber: Repositori Kemdikbud